L’esempio più conosciuto di corrosione dei metalli è il fenomeno dell’arrugginimento del ferro. A ciascuno di noi sarà certamente capitato di maneggia
L’esempio più conosciuto di corrosione dei metalli è il fenomeno dell’arrugginimento del ferro. A ciascuno di noi sarà certamente capitato di maneggiare dei chiodi arrugginiti, o meglio di sentir parlare della pericolosità della ruggine. La formazione della ruggine provoca danni strutturali ma risulta essere pericolosa anche per la salute dell’uomo. Vediamo di capire perché la sua formazione può costituire un evento molto pericoloso per un essere umano.
Per formarsi la ruggine sottrae progressivamente O₂ dall’aria: in ambienti chiusi e non ventilati provocherebbe per un essere umano asfissia. L’asfissia in tal caso sarebbe, quindi, dovuta alla mancanza della percentuale di O₂ minima richiesta per poter respirare. La ruggine, come ci sarà capitato di vedere, è un composto spontaneo che si forma su materiali ferrosi. Essa si presenta come patina grumosa di colore bruno-rossiccio, come evidente in figura, di formula Fe₂0₃٠n H₂O.
Ma cosa la causa?
Il fenomeno della ruggine dipende da vari fattori: può essere ad esempio di carattere chimico (corrosione chimica). Alternativamente tale fenomeno può essere di natura elettrochimica: in questo caso si parla di processo elettrochimico. Il processo di arrugginimento costituisce un tipico esempio di corrosione elettrochimica o meglio definita corrosione galvanica.
Mᶻ⁺ allontanando z elettroni e-. Si ha flusso di elettroni dall’anodo (polo negativo con potenziale minore) al catodo (polo positivo con potenziale maggiore). Si parla di ambiente di corrosione a umido se avviene in presenza di H₂O o di un altro elettrolita.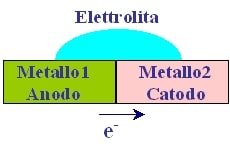
La corrosione galvanica si innesca tra 2 metalli posti a contatto aventi nobiltà diversa in presenza di un terzo elemento, un elettrolita. Il sistema può essere visto come una cella galvanica (macrocoppia) in condizione di corto circuito. I due metalli accoppiati costituiscono gli elettrodi della cella galvanica.
Come anticipato sopra, il flusso di elettroni va dal metallo meno nobile (anodo) al metallo più nobile (catodo). I metalli più nobili (quali argento, acciaio inossidabile) presentano una minore tendenza ad ossidarsi rispetto ai metalli meno nobili (come il ferro ad esempio).

Scala delle nobiltà dei metalli usati in edilizia. Credits: Canadian Copper & brass Development Association,
L’entità del processo dipende sostanzialmente da tre fattori:
- quantità di O₂ presente nell’aria;
- rapporto tra superficie complessiva dei due metalli e superficie del metallo meno nobile;
- differenza di potenziale tra i due metalli (valori ricavabili dalla scala dei potenziali standard o scala galvanica).
Corrosione galvanica: spiegazione del fenomeno elettrochimico che porta alla formazione della ruggine
Spieghiamo cosa accade: immaginiamo di avere una superficie di un metallo (ad esempio: ferro) a temperatura ambiente a contatto con H₂O e in presenza di ARIA. Nella zona anodica avviene la reazione di ossidazione: Fe(s) ➝ Fe²⁺(aq) + 2e⁻. Il Fe passa in soluzione cedendo all’H₂O ioni Fe²⁺. Gli elettroni liberati in corrispondenza dell’anodo migrano attraverso la superficie metallica verso il catodo (parliamo di circuito elettronico). Poiché l’H₂O presenta comportamento anfotero, essa si trova debolmente dissociata come segue: H₂O ➝ H⁺ + OH⁻.
Nella zona catodica gli elettroni prima liberati reagiscono con gli ioni H⁺ (provenienti dal circuito ionico): 2H⁺(aq)+ 2e⁻ ➝ H₂(g). Poiché avviene questa reazione la concentrazione degli ioni H⁺ è minore di quella degli ioni OH⁻ rendendo l’H₂O a contatto con il catodo alcalina. Osserviamo al catodo la formazione di bollicine di H₂ gassoso. L’O₂ disciolto nell’H₂O reagisce con l’H₂: 2H₂ + O₂ ➝ 2H₂O.

